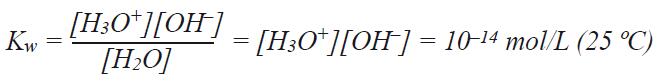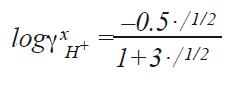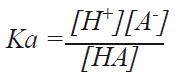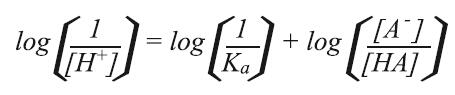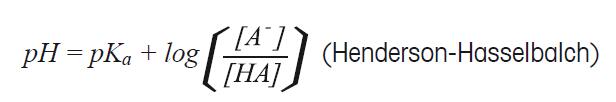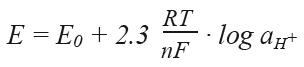实验室pH测量原理与应用(四)
2020.07.28 点击19697次
4. pH综合原理 在之前的章节中,已经讨论了pH测量的实际应用方面。此章节将主要介绍pH测量的理论知识,使读者基本理解pH测量的原理。首先,我们介绍一下pH理论的发展,然后了解电极的原理,最后再讨论几个特殊的主题。 4.1 pH值的定义 根据Sørenson的定义,pH为H3O+离子浓度的负对数: pH = –log [H3O+] 从以上的公式可以看出,H3O+离子浓度每改变十倍,pH值改变一个单位。这很好阐明了测量出样品pH很小变化的重要性。 通常,pH理论描述为H+的浓度,但正确的应描述为水合氢离子H3O+(或根据IUPAC称为oxonium) H+ + H2O ↔ H3O+ 不但酸和碱能解离为水合氢离子或氢氧根离子,而且纯水也能解离为水合氢离子或氢氧根离子 2 H2O ↔ H3O+ + OH– 此过程的解离常数称为Kw,也称为水的自由离或自分解:
从Kw方程可以知道当H3O+和OH-总数相同的时候,溶液呈中性。即[H3O+]和[OH-]都为10-7mol/L时,pH值为7。当H3O+浓度更高时,pH值呈酸性范围,如H3O+浓度为10-3mol/L时([OH-] = 10-11 mol/L)pH值为3。 为了能测量样品的pH值,我们需知道pH电极如何对酸性溶液起作用。我们将在下一章节介绍。 4.2 浓度和活度的关联 我们已经讨论了pH值的数值决定于溶液中酸碱的浓度。事实上pH测量的为溶液中水合氢离子的活度。浓度仅仅在一些化学反应中,作为溶液活度的简称。 在许多情况下浓度非常的接近活度。 氢离子的活度(αH+)由氢离子的浓度和活度系数决定(γH+)。此时的浓度单位为质量摩尔浓度(b = mol/kg溶剂),而不是体积摩尔浓度(c = mol/L溶液),因为质量摩尔浓度是一个更明确的定义。 αH+ = γH+ · bH+ 在稀溶液中,αH+≈bH+活度系数不是一个通用的系数,受到多种因素的影响,比如温度(T),总离子强度(I),导电常数,离子电荷(Z),离子的大小(埃)和介质的密度(d)。 有两点可以显著的影响离子活度和离子浓度的区别。所谓的盐度效应和介质效应。 溶液中盐的影响称为盐度效应,用γxH+表示。 公式为:
公式中的I指总离子强度1⁄2Σciz2i 如果假设pH测量时,阴离子和氢离子都是单价的,zi等于1,则总离子强度由质量摩尔浓度决定。盐度效应对离子活度系数的影响,已列在下表中(盐度效应与活度的关系)。
当比较测量含盐与不含盐的0.01 mol/L HCl时,可得到以下的对照:
从以上的例子可以看出离子浓度高的溶液pH值增加了0.04(氢离子的活度降低了)。这可以解释为什么同样酸含量而离子浓度不同的溶液会有不同的pH值。 第二个影响活度与浓度关系的是介质效应。介质效应定义为: γmH+ 这个影响介质(溶剂)的效应会影响H+活度。此效应中的静电和化学相互作用起到很大的作用。例如,水中的氢离子活度是乙醇溶液中氢离子活度的200倍。 当同时考虑到盐度效应和介质效应,浓度与活度的关系为: αH+ = γxH+ · γmH+ · bH+ 从这个例子中可以看出,了解测量样品的详细性质非常重要。只有在具体的测量环境下,才能得到良好的重复性。 4.3 缓冲溶液 缓冲溶液是pH精确测量的重要构成。标准缓冲液能校准电极和检测电极的性能。就如它的名字,缓冲液最重要的特性是它的缓冲能力。这个特性保证了即使外部物质进入pH缓冲液,缓冲液也能维持恒定的pH值。 缓冲液的缓冲能力由弱酸部分解离的能力所决定,产生以下平衡反应: HA ↔ H+ + A- 在此平衡中,阴离子A-因为能接受系统中的质子,作为碱性物质。而未解离的弱酸HA,则可为系统提供质子。 平衡式中的缓冲液拥有足量的阴离子(A-),可以接受大量的加入系统中的质子,同时也拥有足量的未解离的酸,可以补充系统中失去的质子。由于未解离的酸HA可以视为H+的提供者,解离的A-作为H+的接受者,所以当HA和A-浓度相同时,缓冲液拥有最大的缓冲能力。 如果仔细探究缓冲液的原理,就能发现什么特性的溶液才能作为缓冲液。这些特性包括缓冲能力,温度影响,和稀释缓冲液后pH变化的大小。这些特性在许多缓冲液瓶上都有书面注明。 从以上公式可以得出解离的酸平衡常数:
也可写为
两边取对数
由于log(1/[H+])= –log[H+]= pH, log(1/Ka)= –log Ka = pKa, 可以得到
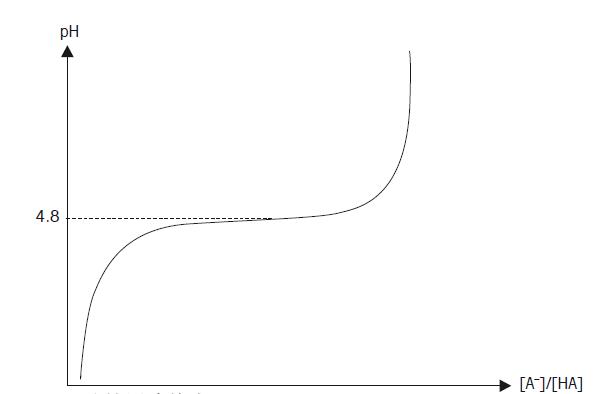
这个方程称为HENDERSON-HASSELBALCH方程。从最后的方程我们可以看出,如果缓冲液缓冲能力强,即[A-] = [HA],则pH值与解离常数的负对数一致, pH = pKa 这个方程非常的有用,可以用已知pKa的弱酸,制作缓冲溶液。 缓冲能力(ß) 缓冲能力的定义为在缓冲液中加入强酸或强碱后,缓冲液保持其原有pH的能力。如前面所述,最佳的缓冲能力为pH = pKa时,但通常弱酸或弱碱的缓冲能力限于pH = pKa ±1。如何判别弱酸的缓冲能力,举个例子可以观察OH–滴定乙酸的曲线(图22)。乙酸的pKa为4.8,所以溶液的初始pH值很低。当加入更多的OH-时,pH值增加。开始时,每滴氢氧化物溶液的加入,会引起很大的改变,但当未解离的酸和解离的酸浓度相同时,曲线变得平坦。由于 [A-] =[HA],pH = pKa, 我们期望曲线在pH 4.8时变得平坦,这个pH值就是所称的缓冲能力。
图22. 乙酸的缓冲能力 当配置和使用缓冲溶液时,需要注意外部因素对酸碱平衡的影响,比如空气中的CO2。 稀释值(ΔpH) 缓冲液的稀释值可以表明当缓冲液用等量的蒸馏水稀释后,所改变的pH值的多少。 稀释后,正的稀释值表明pH值会增加,负的稀释值表明pH值会减少。 温度影响(ΔpH/ΔT) pH值源自溶液中H+的活度。由于离子活度受温度的影响,温度会影响pH值。温度补偿系数表示了每改变1℃,相应pH改变的数值(ΔpH/ΔT)。 1.3章节中指出,pH的测量其实是测量电位。通过参比电极的稳定电位测量pH电极的电位变化。测量的设备已在图7列出。 测量设备的使用原理是连接两根电极中的金属导线,与一种或多种电解液构成原电池。在这个原电池中(pH和参比电极间),连接着带有高阻输入的仪表,测量电位差E。 这个电池的电位差E,由能斯特方程决定:
之前图6已出现过。 为了可以在不同的电极和不同的参比系统中比较原电池电位,使用标准氢电极(SHE)或常规氢电极(NHE),作为常见的参比电极。SHE的电位在任何温度下都为0mV。SHE由镀有铂金的铂片构成,铂片浸入在充满了1bar氢气的αH+ = 1.0的溶液中。 能斯特方程中的E0指αH+=1时的标准电位。2.3RT/nF (EN)是电极的斜率,表示了H+活度每改变十倍或改变了一个pH,测量电位的改变。EN值依赖于开氏温度T,并成为影响斜率的因素。不同温度时的斜率见下图23
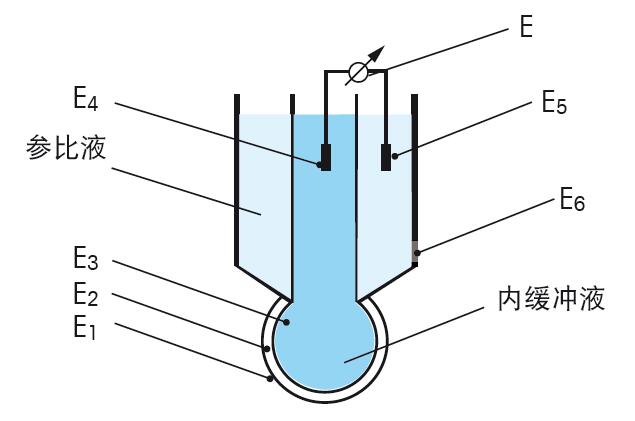
图 23. 温度对电极斜率的影响. 当仔细分析能斯特方程的电位E时,可以得出原电池电位由多种电位组成,见图24。
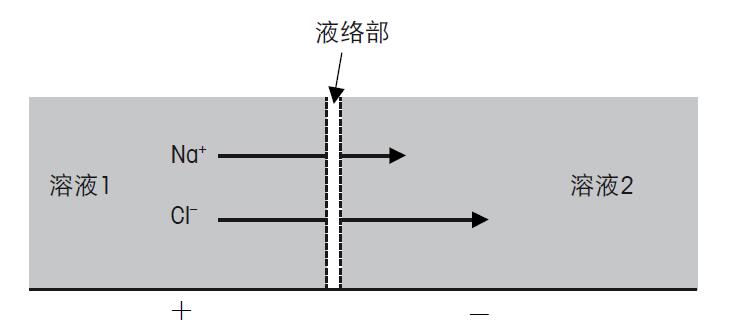
图24.复合电极不同的电位组成 pH电极 电池电位产生于样品溶液与电极玻璃膜的接触处,此处的电位E1可通过与样品溶液pH的关系,计算得出。为了可以测量E1和指定与其相关的pH,所有其它的单独电位E2–E6必须恒定,唯一可变的电信号由pH电极玻璃膜内的电解液与样品溶液电位不同所产生。电位E6是参比电极电解液与样品溶液产生的电位,应为恒定的电位,因为参比电极对样品的pH不敏感。 其它的E2,E3,E4和E5为传输链条从样品通过pH电极传输至仪表,然后再从仪表通过参比电极传回样品溶液的连续步骤。所有这些单独的步骤参见图24。 E1通过外玻璃膜上的凝胶层传输至pH玻璃膜(如图8),同样通过pH电极内部的凝胶层和内缓冲液。玻璃膜外部与内部有不同的电位E2,见图24。物理上讲,电位的转移在测量溶液与外凝胶层发生,通过达到氢离子的平衡进行。如果两相的氢离子活度不同,就会产生氢离子转移。这会导致相间产生电荷,电荷能防止更多H+的转移。这个电位反映了样品溶液与凝胶层间不同活度的氢离子。凝胶层的氢离子数量由玻璃膜的硅酸盐骨架决定,可以认为含量恒定不依赖于测量的溶液。 玻璃膜外凝胶层的电位通过玻璃中的Li+离子传输至玻璃膜内部,这里随之产生另一相界的电位。(图24中的E3)。 然后电位E3通过pH电极的内缓冲溶液传输至pH电极(E4)的导线,并从那里传输至仪表。 参比电极 当pH电极电位(E1–E4)信号到达仪表,就需要有一个仪表可用的参比信号,与测量信号比较测量。这是由电极的参比部分所完成的,参比电极的电位(E5–E6)提供了稳定的,不受样品影响的电位。 仪表通过一根参比导线与参比电极连接,参比导线与参比液形成界面(电位E5)。 不同的参比导线中,银/氯化银导线是最重要的一个。与甘汞电极相比,银/氯化银电极有很多重要的优势,最主要的是环境的原因,促使甘汞电极已完全的退出了市场。 下一步是电位E6,是由参比电极内部的参比液和参比电极的外部的样品所形成。作为一个参比信号,这个电位的稳定性非常重要。自然,液络部作为特殊的接触部位,非常重要。离子通过液络部扩散至样品中。 液络部的关键特性是离子通过液络部扩散会产生扩散电位(E6/Ediff)。扩散电位不仅受到液络部的类型和其特性的影响,同时也受到扩散离子的影响。 由于Ediff是测量中电位的一部分,严格的说,不同样品的pH值需与一个在任何溶液中都一致的扩散电位比较。实际上这是不可能的。所以为了尽量减小测量错误,需要控制 Ediff很小并且恒定。 离子的迁移速度由离子的电荷与大小决定。 离子的大小不是指净尺寸,而是包括水合层的尺寸。水溶液中所有的离子都被极化的水分子所包围。这意味着一个很小但高度水合的Li离子迁移速度比较大但微量水合的K离子的迁移速度慢。由于H+和OH-离子的迁移依据完全不同的机理,它们比其它任何的离子移动速度都快。不同离子的迁移速度可见图25。
图25.离子通过液络部迁移、扩散 以钠离子和氯离子为例,从表中可以看出钠离子和氯离子从溶液1扩散至溶液2的速度不同。由于Cl-的迁移速度快于Na+,就会发生电荷分离。 电荷分离会产生扩散电位,扩散电位能抵消初始的迁移。这样的交替会导致一个动态的平衡,需要很长的时间才能稳定。这意味着不同的离子扩散速度会造成电极响应时间缓慢。所以保持液络部的电解液的高渗透性非常重要,可以尽量减短响应时间。 当阴离子与阳离子的迁移速度差别很大时,电荷分离和扩散电位就会上升。这个现象在强酸和强碱溶液中特别明显,pH测量时经常遇到此类样品。另一个决定Ediff的因素是溶液是否非常的稀。典型的例子是测量离子缺乏型的样品如纯水。 由于液络部外的离子缺乏型样品增强了电荷的落差,扩散电位会加强。 为了尽量减少扩散电位,必须保证使用高浓度并等迁移(阴阳离子迁移速度一致)的参比液。这就是为什么通常使用KCI和KNO3作为参比液,请见图25。 尽管有了这些预防措施,使用了理想的参比电极,但在测量极限pH时,扩散电位仍然不能忽视。 下面的例子证明了这个现象(25℃):
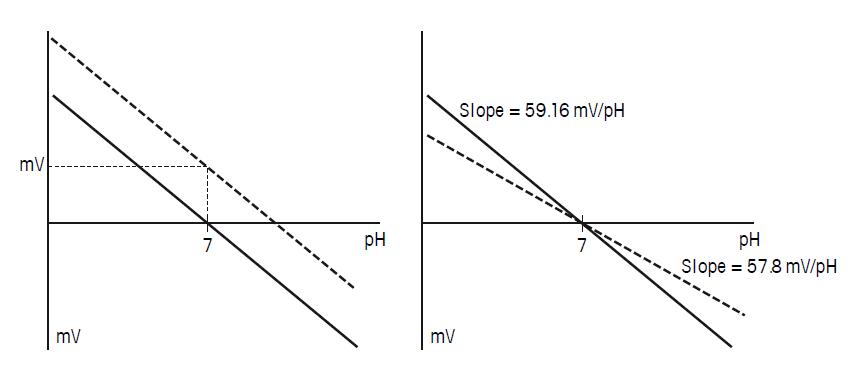
扩散电位的描述,更好解释了测量一些样品的pH非常的困难。测量稀溶液或离子缺陷型溶液如非水溶液,需要特别的注意。这种情况中的扩散电位会非常高,会导致不稳定的参比信号。因为会抑制电解液的顺利渗出,污染的液络部也会有这种现象。 4.5 pH测量的校准/调节设置 仪表中有两种与连在仪表上的具体电极相关联,并且在调节pH电极和仪表设置时会受到影响的设置,分别称为电极的零点漂移(mV)和斜率(mV/pH)。由于有两方面需要校准,所以应执行最少两点校准。 校准零点和斜率可以补偿实际值与理论值的偏移。偏移是由非理想状况的电极产生的。大多数玻璃pH电极,pH7.00的缓冲液相应于零电位,并被用于零点校准。大多数情况下,考虑到待测样品的pH范围,可推荐pH4.01或pH9.21(或10.00)的缓冲液用于斜率校准。 下面的图中,图解了这两方面的校准。左图为零点校准,表示了与理论0mV(pH7.00时)的偏移。右图为斜率的校准,表示了与理论59.16 mV/pH(25℃)的偏移。
图26. 左:pH电极零点校准,右:pH电极斜率校准。实线为理想的状况,虚线为实际的状况。 4.6 温度对pH测量的影响 温度对电极和样品都会产生影响。本节将就此影响作详细的分析。 温度对电极的影响 温度对电极的影响有以下几个方面: 斜率 Nernst 方程给出了对于pH电极测量电位与样品pH值的关系,可以看出这个斜率包含了开氏温度:
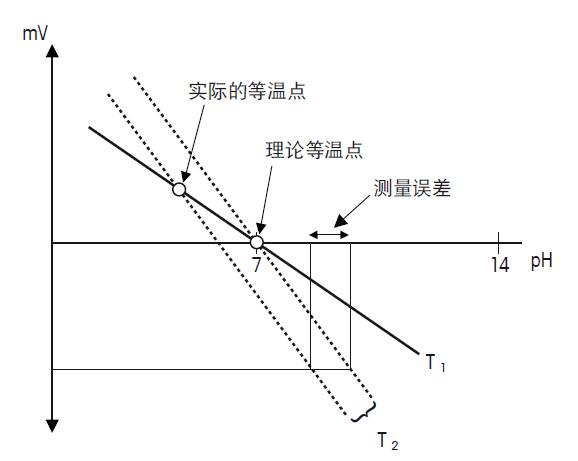
当带入除了开氏温度(T)外的所有数字,可以得到: E = E0 –0.198 · T · pH 从这个方程中,可以清楚地看出电极的斜率与温度呈线性关系。由于此线性关系可以预测,所以可以通过pH仪表和带有温度探头的电极进行补偿。 等温点 每一支电极都有其自身的等温点,等温点由电位E1至E6所决定。理想电极,不同温度的校准线都应在零点交叉(pH 7.00/0 mV),而且斜率应与绝对温度呈一定的比例。 由于pH电极的总电位由E1-E6的总合组成,其中每一个电位对温度有其各自的关系,所以等温点通常不会与电极的零点一致。 电极的等温点应尽量与零点接近,因为等温点越是接近pH7,温度补偿的误差就越小。 校准温度与样品温度差别越大,测量误差就越大,误差最大约有0.1pH。为了得到最精确的pH测量值,应保持校准与样品溶液温度相同。 测量误差请见图27.
图27. 理论与实际的等温点 如果实际等温点与理论的不一致,若样品与样品间或样品与校准间的温度相差过大,会造成较大的测量误差。 此外,如果实际等温点远远偏离理论等温点,并且测量校准在不同的温度下,误差会非常的严重。 更多的温度现象 如果测量过程中有温度变化,电极的响应时间会受到影响。 如果样品的温度快速变化,常规的pH电极会产生飘移,直到电极与样品温度达到平衡。为了使复合电极对样品温度响应迅速,必须保证pH电极和参比电极保持一致。所以pH和参比的引线需要对称的排列。 测量样品温度的影响 每一个样品溶液具有独特的温度特性和pH特征,这就是所谓的温度的补偿系数。它表示了当温度变化,pH值如何变化。 由于每个样品pH变化的程度不同,若需补偿这个系数,是不可能实现的。必须指出一点,水的解离常数本身受温度影响。纯水中当温度从0升至100℃,中性点会向下改变1.34pH单位,这是由于温度影响了离子积。另一种描述是当温度上升时,水的Kw会降低。同样的情况也会在弱酸和弱碱中看到,这也是因为解离常数受到温度的影响。 温度系数决定于以下两个参数: • 活度系数(γ) • 酸常数 当γ远离1时,即当溶液的浓度和活度存在较大偏差时,活度常数γ的温度依赖会增大。这种情况特别在浓缩溶液和含高价电荷的离子的溶液中会特别容易发生。 酸度常数pKa也由温度决定,但呈非线性关系,这意味着酸的解离特性受温度影响而改变。当温度改变,这种解离特性导致了H+浓度的变化,所以pH值也发生了改变。 通常,有机酸/碱系统比无机系统表现出更高的温度系数,并且碱性溶液比酸性溶液受到更大的温度影响。 参见以下的例子:
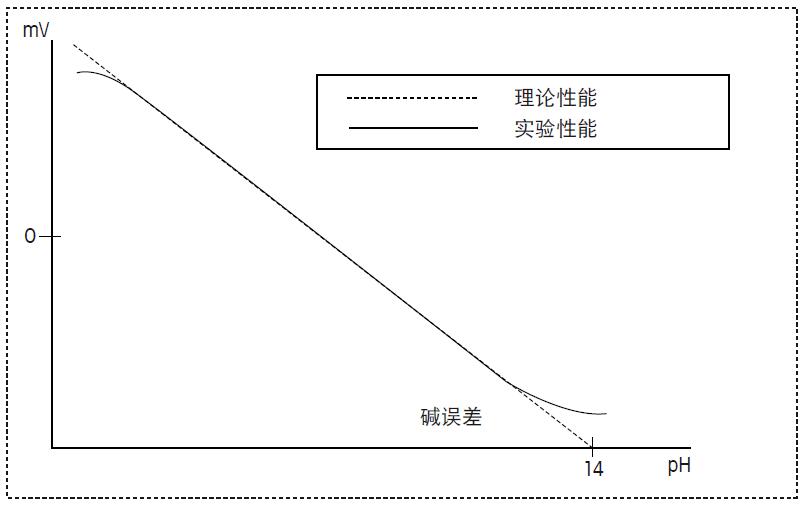
这个例子清楚的显示了即使溶液接近中性pH也会有很大的温度系数。因此若需比较在不同温度下测量的pH值,必须考虑温度因素。理想的来说,样品需在相同的温度下测量,才能进行对比。 通常,对化学溶液的pH进行温度补偿是不可能的。然而,可以对标准缓冲溶液制定温度补偿表。Mettler Toledo的标准缓冲溶液温度补偿表见附录5.1。此表已预置于Mettler Toledo pH仪表中,并且当温度探头插入pH仪表时可自动的调用。这样可以确保在进行校准时,所使用的缓冲液pH值为实际温度下的正确pH值。 4.7 测量特殊溶液 当测量的样品不是水性溶液,测量非常困难。这个问题是由电子或化学方面所造成的,将在本节做简单讨论。 碱误差 当pH敏感膜凝胶层中的H+部分或完全地被碱性离子取代,就会产生碱性效应。这就导致了所测量的pH比样品实际的pH低。在极限的条件下,玻璃膜会忽略H+活度,仅对钠离子响应。 尽管此效应称为碱误差,但实际上只有钠离子或锂离子才会产生一定的误差。当温度增加且pH>9时,此效应会更明显。当使用了特殊的pH玻璃膜后,碱误差会减小。图28举例了电极的碱效应。 酸误差 在强酸介质中,凝胶层会吸附酸性分子,导致凝胶层中的H+活度减少。因此会产生人为的高pH。酸误差的影响比碱误差小,并只在非常低的pH值时才会发生。酸误差也可见图28。
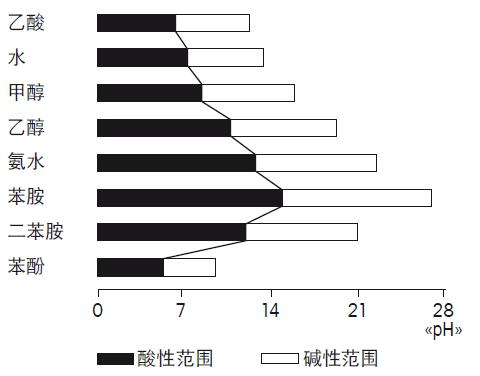
图 28. 电极酸碱误差图示 与参比液反应 样品与参比液发生的化学反应会产生很多问题。所产生的沉淀物会堵塞液络部小孔,并增加了电阻。 当使用KCI作为参比液,测量以下的离子会产生沉淀物和低溶解度的化合物: Hg2+, Ag+, Pb2+, CIO4- AgCl会与Br-,I-,CN-,特别是S2-和硫化物如胱氨酸和半胱氨酸硫化银造成的污染物导致液络部变黑。如章节2.1描述,液络部的污染物会造成测量的问题,这是因为: • 电极响应缓慢 • 扩散电位导致pH测量误差 为了防止此类的反应,可使用不会与以上离子发生反应的电解液,或使用双液络部和配有不会与样品反应盐桥电解液的电极。 有机介质 测量有机介质或非水溶液(水含量小于5%)的pH值,非常的困难。因为经典的pH的定义不适用于此类样品。 当测量非水溶液的pH时,需注意基于水解离特征的常规pH范围pH0至pH14不适用于此类样品。此时的解离平衡,即为溶媒的离子乘积,而与水的离子乘积无关。这将导致溶媒的中H+浓度范围的截然不同,并且pH范围也完全不同。图29为一些常见溶液的实际pH范围。
图29. 不同溶液的pH范围 测量非水溶液的pH,实际所测量的为相对pH而不是实际pH。以滴定油类样品为例,当反应完成时,应观察电位突越点而不是pH范围。 当测量非水样品,必须注意所测的pH并非绝对pH。此外,电极的敏感膜会失去水合凝胶层。为了确认测量是否能正常进行,试验间隔中应把电极浸泡在富含离子的水溶液中重新水化。 如果要在非水性溶剂中进行定量测量,那么可采用已知其成分与待测样品情况相对应的不同样品来绘制pH玻璃电极的校准曲线。这使之在测量期间无需量化一个绝对值即可区分不同的样品成分。 请注意非水溶液通常为离子缺乏型,会导致测量的不稳定。 5. 附录 5.1. METTLER TOLEDO缓冲液温度对应表
| 产品分类
重点推荐产品
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |