中国学者《Cell》:发现第一次细胞命运决定的新模式
2018.12.17 点击1820次
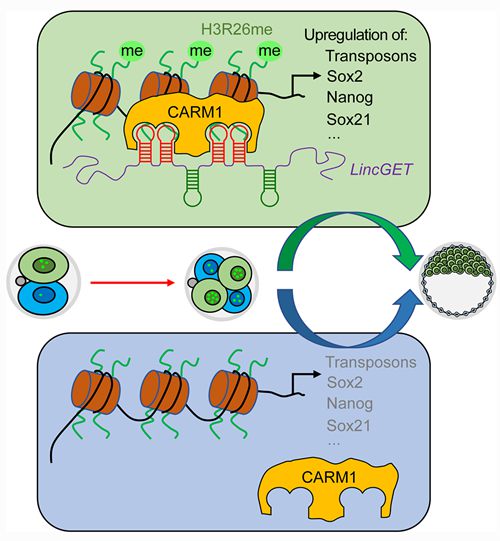
中国科学院动物研究所周琪课题组与李伟课题组的合作研究论文“Asymmetric expression of LincGET biases cell fate in 2-cell mouse embryos”于2018年12月13日在Cell在线发表。该研究发现小鼠发育过程中的第一次细胞命运决定事件在2-细胞胚胎时期就发生,通过一个长非编码RNA LincGET在2-细胞胚胎两个卵裂球之间的差异表达及下游调控来影响细胞的第一次命运选择。 一个哺乳动物个体有超过200种不同的细胞类型,而所有的细胞类型都由一个初始细胞--受精卵,不断地分裂和分化形成。在受精卵的分裂和发育过程中,第一次细胞命运的选择发生在什么时期?这一选择是如何发生的?这是生殖与发育生物学研究的一个重要的基础问题。 小鼠的早期胚胎发育是研究细胞多能性和细胞命运决定的最常见模型。前人研究证据表明,小鼠胚胎早在4-细胞期甚至2-细胞期,不同卵裂球之间就已经出现了差异1。目前已知的能够调控细胞命运选择的分子差异最早出现在4-细胞时期。那么在更早的2-细胞胚胎时期是否有可能已经启动了细胞命运的选择呢? 2016年,中国科学院动物研究所周琪课题组和东北农业大学刘忠华课题组曾合作发现了一个内源逆转录病毒相关的长非编码RNA,LincGET,是小鼠胚胎发育超过2-细胞期所必需的2。鉴于LincGET在小鼠发育中具有如此重要的功能,中国科学院动物研究所周琪和李伟两课题组合作团队的研究人员对LincGET在早期细胞命运决定中的作用及详细机制进行了进一步深入探索。
LincGET在2-细胞期的两个卵裂球之间不均等表达,通过CARM1调控细胞命运选择 研究发现,LincGET的表达水平在小鼠2-细胞期和4-细胞期的各个卵裂球之间是不均等的。通过显微注射的方法在2-细胞胚胎的一个卵裂球中过表达LincGET,能使该卵裂球的子细胞选择内细胞团(inner cell mass, ICM)命运。进一步的机制研究显示,LincGET与CARM1形成复合体,偏好性地结合转座序列,建立激活型染色质修饰H3R26me2,增加全基因组染色质的开放程度,提高多能性相关基因的表达水平,从而促使具有更高LincGET表达水平的胚胎细胞倾向于选择ICM命运倾向。 这一工作首次将小鼠第一次细胞命运分化的选择推到了2-细胞胚胎时期,并发现其关键分子是一个内源逆转录病毒相关的长非编码RNA。这将为探索早期胚胎的全能性调控以及第一次细胞命运分化机理奠定重要基础,并为建立更高多能性甚至全能性的干细胞提供了新的理论参考。同时,该研究也拓展了长非编码RNA的功能研究,为研究早期胚胎中内源逆转录病毒序列和长非编码RNA的功能提供了新的思路。 研究工作由中国科学院动物研究所和中国科学院干细胞与再生医学创新研究院合作完成。博士后王加强、王乐韵、副研究员冯桂海、助理研究员王昱凯为论文共同第一作者,周琪研究员和李伟研究员为论文的共同通讯作者。该课题得到了中国科学院、科技部和国家自然科学基金委的资金支持。 | 产品分类
|
 |