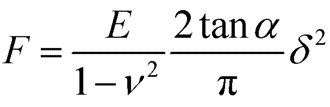Nanoscale:使用原子力显微镜对细胞间质的刚度进行断层扫描
作者:瑞科和利 2024.07.04 点击484次
使用原子力显微镜可以很容易的研究细胞表面的形貌以及力学性质,在2019年发表于Nanoscale的文章中Nanoscale, 2019,11, 10320-10328, https://doi.org/10.1039/C8NR08955H)里尔巴斯德研究所的Frank Lafont等将布鲁克NanoWizard Ultra Speed生物型原子力显微镜与STED超分辨荧光显微镜相结合,在纳米尺度上对细胞内的细胞器和微生物进行了表征。作者分别对感染了假结核病杆菌(Yersinia pseudotuberculosis)的固定PtK2细胞和活细胞中的线粒体进行了测试。 作者使用弹性系数大约0.09N/m、曲率半径大约8nm的AC40探针测试细胞样品的模量和硬度,利用BioAFM的SPM软件进行Sader法校准(Contact-free)探针。在使用QI模式进行扫描时,作用力被设定为不损坏细胞的情况下的*值。对于固定细胞作用力大约3 nN,活细胞大约1 nN。通过明场显微镜观察细胞的形态和QI模式中力曲线是否发生破裂(rupture event)即可判断细胞是否受损。得益于NanoWizard UltraSpeed原子力显微镜的高速性能,探针在Z方向的速度(Z speed)达到了300 μm/s,Z方向距离(Z range)为2 μm,力曲线的噪声控制在19-24 pN。
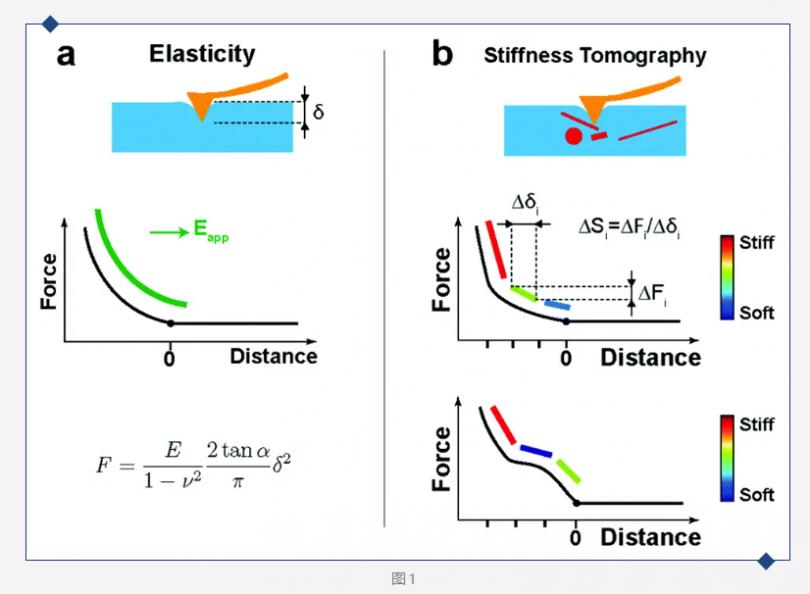
图1 (a) 使用Sneddon模型拟合压入曲线(黑色),计算自接触点(POC)处的表观杨氏模量(绿色);(b) 由于检测到的细胞内部模量不同而导致的力-距离曲线的扭曲,形成不同刚度的片段(从蓝色:软 到 红色:硬)。 细胞的弹性模量使用Sneddon模型拟合下压力曲线(Approach FD curve)得到。样品的型变量δ与接触力F、样品的杨氏模量E、泊松比ν和探针*的半角α都有关系。虽然AC40的针尖形状既不是纯球形也不是圆锥形,但在较大压入深度下,可以看作是圆锥形。(图1 a)
然而,当在细胞上使用相对小的压头进行大压入深度实验时,FD力曲线显示出非线性和不均匀性(图1b),这对应于细胞内部结构刚度的差异。这时使用传统的Hertz/Sneddon模型不能恰当地描述数据。如果分段拟合下压曲线的斜率,就可以获得每一段的刚度数值: ΔSi = ΔFi/Δδi, 其中Si是刚度,Fi是力,δi是段i的压入深度。作者使用自自行开发的软件(pyAF,Python原子力)进行的数据处理就可以得到刚度断层数据。
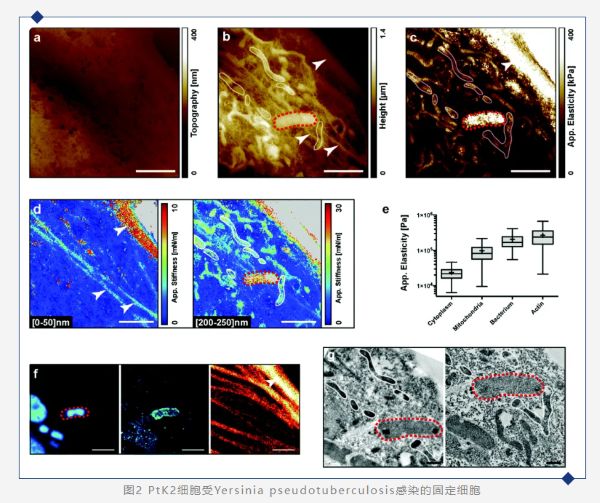
(a) 细胞表面形貌图(作用力为零,平面拟合)。(b) 细胞表面受作用力后的形貌图(3 nN,平面拟合)。(c) 在每个点拟合FD力曲线计算的表观弹性模量图。(d) 不同压入深度下的刚度断层图:左侧:[0–50] nm,右侧:[200–250] nm。(e) 对应于不同细胞内区域的表观弹性模量。(f) 结合STED超分辨率显微镜识别细胞区域。左:DAPI,中:LC3,右:肌动蛋白。(g) 结合透射电子显微镜获得的超微结构(2张切片)。白色箭头:肌动蛋白;红色虚线:细菌;白色环:线粒体。比例尺:白色:2 μm,黑色:500 nm。 为了测试细胞内微生物的模量,作者对感染了假结核病杆菌(Yersinia pseudotuberculosis)的固定PtK2细胞进行了原子力显微镜(AFM)实验。细胞被感染后固定,并标记了肌动蛋白细胞骨架、细菌和LC3阳性的自噬泡。通过明场显微镜、荧光显微镜、AFM以及电子显微镜依次对单个细胞进行成像(图2a、f和g)。图2a显示了细胞在探针作用力为零时的图像。此时细胞内部区域不可见,但我们可以观察到固定对膜孔的影响。图2b显示了在*压入深度时细胞的高度图。样品内的不同硬度导致了相同施加力的不同*压入深度。一些结构(可能对应于细菌、线粒体和肌动蛋白细胞骨架)变得清晰可见。经荧光和电子显微镜可以确认细菌(红色虚线)的位置(图2f和g)。细菌用DAPI和LC3标记,表明细菌位于自噬泡中(图2f左和中)。AFM和荧光观察还可以获得有关肌动蛋白细胞骨架的相关性。*,线粒体通过电子显微镜观察到(图2g)。通过表观弹性模量图(图2c)可以看出来肌动蛋白池和细菌的似乎比线粒体更硬。通过对不同感兴趣区域的弹性模量进行量化可以证实这一点(图2e)。对同一数据上在两个压入深度[0–50] nm和[200–250] nm上执行了刚度断层扫描(图2d)后,可以发现在低压入深度时,可以识别出3个肌动蛋白束。在更大的压入深度时,这些束消失了。这表明它们位于细胞顶部,而AFM在细胞更深处探测到了几个线粒体。
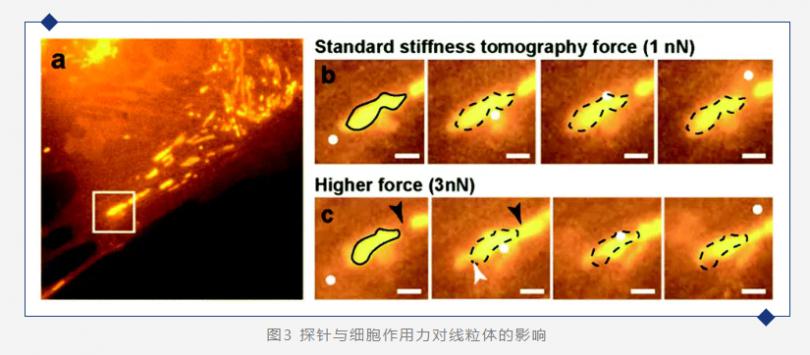
(a) 显示了活体PtK2细胞内线粒体的大尺度荧光图像,白色方框突出显示了AFM扫描区域;(b) 以1 nN作用力进行扫描的线粒体的时间序列荧光图像;(c) 以3 nN触发力进行扫描的线粒体的时间序列荧光图像。比例尺:1 μm,白色方框:AFM扫描区域;白色圆盘:AFM探针位置;黑色环:原始线粒体形状;黑色箭头:融合位点;白色箭头:分裂位点。 作者随后在37°C的HEPES缓冲介质中对活细胞进行了压入实验。如图3b所示,普通大小的作用力并不会产生线粒体的形态学变化。然后,作者通过施加更高的触发力(图3c)能够移动、融合甚至分裂一些线粒体。选择适当的力用于活细胞刚度测量非常重要。实际的作用力将取决于细胞类型以及针尖的几何形状,因为更尖锐的针尖将对细胞产生更大的局部影响。实验中作用力设置为1 nN,对应于平均压入深度为400 nm。
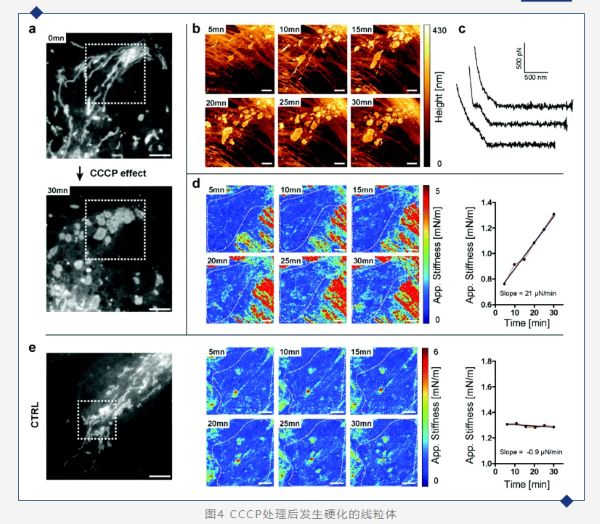
(a) CCCP处理前后活体PtK2细胞内线粒体的荧光图像,0分钟(顶部)和30分钟(底部)(比例尺5 μm);(b) 1 nN下的AFM测得形貌;(c) 实验中的样品下压FD力曲线。顶部:均匀弹性材料;中部和底部:由于遇到硬细胞器而产生的两个不连续的示例;(d) CCCP处理细胞在[50–100] nm压入深度处的刚度图(比例尺2 μm)(左)随时间变化的线粒体区域(白色虚线)的对应刚度值(右);(e) 对照组活体PtK2细胞内线粒体的荧光图像(比例尺5 μm)(左),对照组细胞在[60–120] nm压入深度处的刚度图(比例尺2 μm)(中),随时间变化线粒体区域(白色虚线)的对应刚度值(右)。 接下来作者使用控制药物碳酰氯化苯基腙(CCCP)来干扰线粒体生理学,该药物可以解偶线粒体氧化磷酸化并主要作为质子载体,降低ATP合酶的功能。同时使用光学显微镜和原子力显微镜(图4a和b)能够实时跟踪药物对线粒体伸长结构的破坏作用,*终导致线粒体碎裂。实验开始时,大多数线粒体呈纤维状。在暴露于药物5分钟后,已经能够检测到线粒体管状网络的紊乱(图4a和b)。通过力曲线(图4c)可以观察到细胞内结构硬度的增加(图4d)。结合光学显微镜,能够确认这些结构与线粒体碎片有关。在对照组中,未经处理的细胞中没有测量到这种剧烈的硬度变化(图4e)。 在本文中,作者展示了观察和感知细胞内膜组分的可能性。使用布鲁克BioAFM型原子力显微镜可以与各种光学显微镜相结合精确定位细胞内的细胞器和微生物并了解它们的机械性质。刚度断层成像利用力曲线获得的刚度的对比度,无需特定的样品处理或染色即可定位细胞内的结构,它提供了到目前为止通过其他技术无法获得的纳米尺度上的机械信息。光学显微镜和透射电子显微镜为机械性能提供了宝贵且互补的信息。前者可以实时识别细胞组分,而后者允许对样品进行超微结构分析。
本文来自:瑞科和利 | 产品分类
重点推荐产品
|