钠(Na)
钠是有银白色光泽的软金属,用小刀就能很容易的切割。熔点97.81℃,沸点882.9℃,密度0.97克/厘米³。通常保存在煤油中。钠是一种活泼的金属。钠与水会产生激烈的反应,生成氢氧化钠和氢;钠还能与钾、锡、锑等金属生成和金;金属钠与汞反应生成汞齐,这种合金是一种活泼的还原剂,在许多时候比纯钠更适用。钠离子能使火焰呈黄色,可用来灵敏地检测钠的存在。
以往金属钠主要用于制造车用汽油的抗暴剂,但由于会污染环境,已经日趋减少。金属钠还用来制取钛,及生产氢氧化钠、氨基钠、氰化钠等。熔融的金属钠在增值反应堆中可做热交换剂。
| 元素名称 | 钠 | 元素符号 | Na | 原子序数 | 11 | 相对原子质量
(12C=12.0000) | 22.989768 |
| 英文名称 | Sodium |
| 原子结构 | 原子半径(Å) | 2.23 | 原子体积(cm3/mol) | 23.70 | 电子模型 | 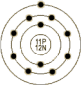
|
| 电子构型 | 1s2 2S2P6 3S1 | 离子半径(Å) | 1.02 |
| 共价半径(Å) | 1.54 | 氧化态 | 1 |
| 发现 | 1807年在英国伦敦,英国科学研究所,由 Humphry Davy 先生分离出。 |
| 命名起源 | from 'soda' (English) |
| 来源 | 由电解氯化钠、硼砂和冰晶石而得。 |
| 用途 | 用在医药、农业和摄影等方面,也用于制造路灯、电池和玻璃等。 |
| 物理性质 | 状态 | 软质的银白色碱性金属 | 熔 点(℃) | 883 | 沸 点(℃) | 883 |
| 密度(g/cc,300K) | 0.971 | 比 热(J/gK) | 1.23 | 蒸发热(KJ/mol) | 96.96 |
| 熔化热(KJ/mol) | 2.598 | 导电率(106/cm) | 0.21 | 导热系数(W/cmK) | 1.41 |
| 自燃点(℃) | | 闪 点(℃) | | | |
| 化学性质 | |
| 地质数据 | 丰 度 | | 滞留时间(年) | 1×108 | 太阳
(相对于 H=1×1012) | 1.91×106 |
| 海水中(ppm) | 10500 | 地壳(ppm) | 23000 | 大西洋表面 | - |
| 太平洋表面 | - | 大气(ppm(体积)) | - | 大西洋深处 | - |
| 太平洋深处 | - | | | | |
| 生物数据 | 人体中含量 | | 肝(ppm) | 2000-4000 |
| 器官中 | | 肌肉(ppm) | 2600-7800 |
| 血(mg dm-3) | 1970 | 日摄入量(mg) | 2-15 |
| 骨(ppm) | 10000 | 人(70Kg)均体内总量(mg) | 100 |
钠的同位素信息
| 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 |
| [22] | 0 | 21.994436 | | | | | | |
| 23 | 100 | 22.98977 | 3/2 | 2.8629811 | 7.0808493 | 10.4 | 26.4519 | 9.27×10-2 |
| [24] | 0 | 23.990963 | | | | | | |