氦(He)
氦,原子序数2,原子量4.002602,为稀有气体的一种。元素名来源于希腊文,原意是“太阳”。1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。以后又陆续从其他矿石、空气和天然气中发现了氦。氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。氦在空气中的含量为0.0005%。氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2℃(25个大气压),沸点-268.9℃;密度0.1785克/升,临界温度-267.8℃,临界压力2.26大气压;水中溶解度8.61厘米3/千克水。氦是唯一不能在标准大气压下固化的物质。液态氦在温度下降至2.18K时,性质发生突变,成为一种超流体,能沿容器壁向上流动,热传导性为铜的800倍,并变成超导体;其比热容、表面张力、压缩性都是反常的。
氦是最不活泼的元素,基本上不形成什么化合物。氦的应用主要是作为保护气体、气冷式核反应堆的工作流体和超低温冷冻剂等等。 | 元素名称 | 氦 | 元素符号 | He | 原子序数 | 2 | 相对原子质量
(12C=12.0000) | 4.002602 | | 英文名称 | Helium | | 原子结构 | 原子半径(Å) | 0.49 | 原子体积(cm3/mol) | - | 电子模型 | 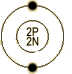
| | 电子构型 | 1s2 | 离子半径(Å) | - | | 共价半径(Å) | 0.93 | 氧化态 | - | | 发现 | Norman Lockyer 和 Edward Frankland 在1868年的一次日食期间, 从太阳光谱中观测到。 | | 命名起源 | from 'helios' (Greek) - sun | | 来源 | 在宇宙中,氦是仅次于氢的第二个最丰富的元素。 | | 用途 | 用于深海潜水,超低温研究,核能系统的冷却剂。 | | 物理性质 | 状态 | 轻的无臭、无色、
无味的惰性气体。
极易燃烧的气体。 | 熔 点(℃) | -272.05 | 沸 点(℃) | -268.785 | | 密度(g/cc,300K) | 0.1785 | 比 热(J/gK) | 5.193 | 蒸发热(KJ/mol) | | | 熔化热(KJ/mol) | 5.23 | 导电率(106/cm) | - | 导热系数(W/cmK) | 0.00152 | | 自燃点(℃) | | 闪 点(℃) | | | | | 化学性质 | | | 地质数据 | 丰 度 | | 滞留时间(年) | | 太阳
(相对于 H=1×1012) | 6.31×1010 | | 海水中(ppm) | 4×10-6 | 地壳(ppm) | 0.008 | 大西洋表面 | | | 太平洋表面 | | 大气(ppm(体积)) | 5.2 | 大西洋深处 | | | 太平洋深处 | | | | | | | 生物数据 | 人体中含量 | | 肝(ppm) | - | | 器官中 | | 肌肉(ppm) | - | | 血(mg dm-3) | 痕量 | 日摄入量(mg) | | | 骨(ppm) | - | 人(70Kg)均体内总量(mg) | - |
氦的同位素信息 | 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 | | 3 | 0.000137 | 3.016029 | 1/2 | -3.685154336 | -20.3801587 | 0 | 76.179437 | 6.06×10-7 | | 4 | 99.999863 | 4.002606 | | | | | | |
| |
您可能感兴趣的产品:
|