氮(N)
氮,原子序数7,原子量为14.006747。元素名来源于希腊文,原意是“硝石”。1772年由瑞典药剂师舍勒和英国化学家卢瑟福同时发现,后由法国科学家拉瓦锡确定是一种元素。氮在地壳中的含量为0.0046%,自然界绝大部分的氮是以单质分子氮气的形式存在于大气中,氮气占空气体积的78%。氮的最重要的矿物是硝酸盐。氮有两种天然同位素:氮14和氮15,其中氮14的丰度为99.625%。
氮为无色、无味的气体,熔点-209.86℃,沸点-195.8℃,气体密度1.25046克/升,临界温度-146.95℃,临界压力33.54大气压。
氮分子是由两个氮原子组成,特别稳定,它对许多反应试剂是惰性的。在高温、高压并有催化剂存在的情况下,氮和氢作用生成氨。空气中的单质氮和氧在雷电的作用下,可生成氧化氮。锂和氮在常温下即可反应,过渡金属在高温下也可和氮反应,生成氮化物。
氮是组成动植物体内蛋白质的重要成分,但高等动物及大多数植物不能直接吸收氮。氮主要用来制造氨,其次是制备氮化物、氰化物、硝酸及其盐类等。此外,还可用作保护性气体、泡沫塑料中的发泡剂,液氮可用于冷凝剂。
| 元素名称 | 氮 | 元素符号 | N | 原子序数 | 7 | 相对原子质量
(12C=12.0000) | 14.00674 |
| 英文名称 | Nitrogen |
| 原子结构 | 原子半径(Å) | 0.75 | 原子体积(cm3/mol) | 17.3 | 电子模型 | 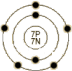
|
| 电子构型 | 1s2 2S2P3 | 离子半径(Å) | 0.13 |
| 共价半径(Å) | 0.75 | 氧化态 | - |
| 发现 | 1772年在苏格兰爱丁堡,由 D. Rutherford 发现。 |
| 命名起源 | from 'nitron genes' (Greek) - nitre forming |
| 来源 | 空气中含有大量的氮气,工业上制氮气是采用液化空气,然后分馏而得。 |
| 用途 | 氮作为气体,具有很多工业用途,液氮具有非常低的温度,所以,用于低温储藏精子,卵子等,作为惰性气体,用食品及化学物质的储藏,
以防止其氧化。 |
| 物理性质 | 状态 | 无色、无味、无臭的气体 | 熔 点(℃) | -209.86 | 沸 点(℃) | -195.65 |
| 密度(g/cc,300K) | 1.2506 | 比 热(J/gK) | 1.04 | 蒸发热(KJ/mol) | 2.7928 |
| 熔化热(KJ/mol) | 0.3604 | 导电率(106/cm) | - | 导热系数(W/cmK) | 0.0002598 |
| 自燃点(℃) | | 闪 点(℃) | | | |
| 化学性质 | |
| 地质数据 | 丰 度 | | 滞留时间(年) | 6000 | 太阳
(相对于 H=1×1012) | 8.71×107 |
| 海水中(ppm) | - | 地壳(ppm) | 25 | 大西洋表面 | 0.00008 |
| 太平洋表面 | 0.0008 | 大气(ppm(体积)) | 780900 | 大西洋深处 | 0.27 |
| 太平洋深处 | 0.54 | | | | |
| 生物数据 | 人体中含量 | | 肝(ppm) | 7200 |
| 器官中 | | 肌肉(ppm) | 7200 |
| 血(mg dm-3) | 34300 | 日摄入量(mg) | - |
| 骨(ppm) | 4300 | 人(70Kg)均体内总量(mg) | 1.8 |
氮的同位素信息
| 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 |
| [13] | 0 | 13.005738 | | | | | | |
| 14 | 99.634 | 14.003074005 | 1 | 0.57100428 | 1.9337792 | 2.044 | 7.226317 | 1.00×10-3 |
| 15 | 0.366 | 15.000108898 | 1/2 | -0.49049746 | -2.71261804 | 0 | 10.136767 | 3.84×10-6 |