氡(Rn)
氡,无色无味,产生于岩石和土壤中铀的放射性衰变,在水中也可找到。释放到空气中的氡在分解过程中产生放射性的阿尔法粒子,这些粒子会附着于空气中的浮尘上,进入人体后,会堆积于呼吸道壁层的细胞中,破坏细胞DNA(脱氧核糖核酸)甚至引发肺癌。
氡,原子序数86,是天然放射性元素,稀有气体。1899年欧文斯和卢瑟福在研究钍的放射性时发现氡,当时称为钍射气,即氡220;1900年多恩在镭制品中发现氡222;现已发现质量数199~226的全部氡同位素。其中天然同位素只有氡219、220、222。
氡熔点-71℃,沸点-61.8℃,气体密度9.73克/升;水溶解度4.933克/千克水,也易溶于有机溶剂,如煤油、二硫化碳等中;氡很容易吸附于橡胶、活性炭、硅胶和其他吸附剂上。天然放射性元素。无色无臭气体。化学性质极不活泼,没有稳定的核素。具有危险的放射性,这种放射性可以破坏形成的任何化合物。
氡较容易压缩成无色发磷光的液体,固体氡有天蓝色的钻石光泽。氡的化学性质极不活泼,以制得的氡化合物只有氟化氡,它与氙的相应化合物类似,但更稳定,更不易挥发。氡主要用于放射性物质的研究,可做实验中的中子源;还可用作气体示踪剂,用于研究管道泄漏和气体运动等。
| 元素名称 | 氡 | 元素符号 | Rn | 原子序数 | 86 | 相对原子质量
(12C=12.0000) | 222.0176 |
| 英文名称 | Radon |
| 原子结构 | 原子半径(Å) | 1.34 | 原子体积(cm3/mol) | 50.5 | 电子模型 | 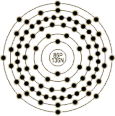
|
| 电子构型 | 1s2 2s2p6 3s2p6d10 4s2p6d10f14 5s2p6d10 6s2p6 | 离子半径(Å) | |
| 共价半径(Å) | - | 氧化态 | 0 |
| 发现 | 1900年由F.E. Dorn (德国,Halle)发现。 |
| 命名起源 | after the element 'radium' |
| 来源 | 由地壳中的镭衰变形成。 |
| 用途 | 用于治疗某些癌症,也用于地震预测。 |
| 物理性质 | 状态 | 无色,无味,无臭的放射性惰性气体。 | 熔 点(℃) | -71 | 沸 点(℃) | -62 |
| 密度(g/cc,300K) | 9.73 | 比 热(J/gK) | 0.09 | 蒸发热(KJ/mol) | 16.4 |
| 熔化热(KJ/mol) | 2.89 | 导电率(106/cm) | - | 导热系数(W/cmK) | 0.0000364 |
| 自燃点(℃) | - | 闪 点(℃) | - | | |
| 化学性质 | |
| 地质数据 | 丰 度 | | 滞留时间(年) | - | 太阳
(相对于 H=1×1012) | - |
| 海水中(ppm) | c.1×10-14 | 地壳(ppm) | 痕量 | 大西洋表面 | - |
| 太平洋表面 | - | 大气(ppm(体积)) | 1×10-15 | 大西洋深处 | - |
| 太平洋深处 | - | | | | |
| 生物数据 | 人体中含量 | | 肝(ppm) | - |
| 器官中 | | 肌肉(ppm) | - |
| 血(mg dm-3) | - | 日摄入量(mg) | 零 |
| 骨(ppm) | - | 人(70Kg)均体内总量(mg) | 零 |
氡的同位素信息
| 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 |
| [210] | - | 209.98968 | | | | | | |
| [211] | - | 210.99059 | | | | | | |
| [220] | - | 220.01138 | | | | | | |
| [222] | - | 222.01757 | | | | | | |