镭(Ra)
镭,是荧蓝色/银白色金属,是最活泼的碱土金属。镭在空气中可迅速与氮气和氧气生成氮化物和氧化物,与水反应剧烈,生成氢氧化镭和氢气。镭的最外电子层有两个电子,氧化态为+2,只形成+2价化合物。镭盐和相应的钡盐属同晶形化合物,化学性质很相似。镭有剧毒,它能取代人体内的钙并在骨骼中浓集,急性中毒时,会造成骨髓的损伤和造血组织的严重破坏,慢性中毒可引起骨瘤和白血病。
镭属周期系ⅡA族,为碱土金属的成员和天然放射性元素。1898年玛丽.居里和皮埃尔.居里从沥青铀矿提取铀后的矿渣中分离出溴化镭,1910年又用电解氯化镭的方法制得了金属镭,它的英文名称来源于拉丁文radius,含义是“射线”。
1898年居里夫妇从沥青铀矿矿渣中发现了镭,1902年分离出90毫克氯化镭,初步测定了镭的原子量。镭在自然界分布很广,但含量极微,地壳中的含量为十亿分之一,总量约1800万吨。现已发现质量数为206~230的镭的全部同位素,其中只有镭223、224、226、228是天然放射性同位素,其余都是通过人工核反应合成的。镭226半衰期最长,天然丰度最大,是镭的最重要的同位素。
镭是银白色有光泽的金属,熔点700℃,沸点1140℃,密度约5克/厘米3,体心立方晶格。镭的化学性质活泼,与钡相似。金属镭暴露在空气中能迅速反应,生成氧化物和氮化物;能与水反应生成氢氧化镭;新制备的镭盐呈白色,放置后因受辐照而变色。
镭是现代核工业兴起前最重要的放射性物质,广泛应用于医疗、工业和科研领域;把镭盐和硫化锌荧光粉混匀,可制成永久性发光粉。到1975年为止,全世界共生产了约4千克镭,其中85%用于医疗,10%用来制造发光粉。镭是剧毒物质。
镭在地壳中的含量为1×10-9%,已发现质量数为206~230的同位素中,除镭223、镭224、镭226、镭228是天然放射性同位素外,其余都是用人工方法合成的。镭存在于所有的铀矿中,每2.8吨铀矿中含1克镭。
| 元素名称 | 镭 | 元素符号 | Ra | 原子序数 | 88 | 相对原子质量
(12C=12.0000) | 226.0254 |
| 英文名称 | Radium |
| 原子结构 | 原子半径(Å) | 45.2 | 原子体积(cm3/mol) | | 电子模型 | 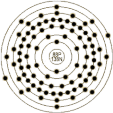
|
| 电子构型 | 1s2 2s2p6 3s2p6d10 4s2p6d10f14 5s2p6d10 6s2p | 离子半径(Å) | 1.43 |
| 共价半径(Å) | - | 氧化态 | 2 |
| 发现 | 1898年由Pierre 和 Marie Curie (法国巴黎)发现,1911年 Mme. Curie 通过电解RaCl2而分离出金属镭。 |
| 命名起源 | from 'radius' (Latin) - ray |
| 来源 | 存在于铀矿,每三百万份铀矿含镭一份。 |
| 用途 | 用铀放出的伽马射线治疗癌症。 |
| 物理性质 | 状态 | 银白色金属,具有非常强的辐射性。 | 熔 点(℃) | 700 | 沸 点(℃) | 1536 |
| 密度(g/cc,300K) | 5.5 | 比 热(J/gK) | 0.12 | 蒸发热(KJ/mol) | - |
| 熔化热(KJ/mol) | 37 | 导电率(106/cm) | - | 导热系数(W/cmK) | 0.186 |
| 自燃点(℃) | - | 闪 点(℃) | - | | |
| 化学性质 | |
| 地质数据 | 丰 度 | | 滞留时间(年) | - | 太阳
(相对于 H=1×1012) | - |
| 海水中(ppm) | 2×10-11 | 地壳(ppm) | 6×10-7 | 大西洋表面 | - |
| 太平洋表面 | - | 大气(ppm(体积)) | - | 大西洋深处 | - |
| 太平洋深处 | - | | | | |
| 生物数据 | 人体中含量 | | 肝(ppm) | 0.023×10-9 |
| 器官中 | | 肌肉(ppm) | 0.23×10-9 |
| 血(mg dm-3) | 6.6×10-9 | 日摄入量(mg) | 2×10-9 |
| 骨(ppm) | 4×10-9 | 人(70Kg)均体内总量(mg) | 31×10-9 |
镭的同位素信息
| 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 |
| [223] | - | 223.018497 | | | | | | |
| [224] | - | 224.020202 | | | | | | |
| [225] | - | 225.023604 | | | | | | |
| [226] | - | 226.025402 | | | | | | |
| [228] | - | 228.03106 | | | | | | |