钍(Th)
钍原子量232.0381,金属,是天然放射性元素。核内质子数90,核外电子数90,核电核数90,质子质量1.5057E-25,质子相对质量90.63,所属周期为7,所属族数为IIIB,摩尔质量180。
钍为银白色金属,长期暴露在大气中渐变为灰色。质较软,可锻造。熔点1750℃,沸点4790℃,密度11.72克/厘米3。在1400℃以下原子排列成面心立方晶体;当加热达到此温度时,便改为体心立方晶体。
钍的化学性质活泼,不溶于稀酸和氢氟酸,但溶于发烟的盐酸、硫酸和王水中。硝酸能使钍纯化。苛性碱对它无作用。高温时可与卤素、硫、氮作用。放射性元素,半衰期约为1.4×1010年。所有钍盐都显示出+4价。在化学性质上与锆、铪相似。除惰性气体外,钍能与所有非金属元素作用,生成二元化合物;室温下与空气和水的反应缓慢,加热后反应迅速。钍是高毒性元素,经过中子轰击,可得铀233,因此它是潜在的核燃料。
钍是一种放射性的四价金属元素,以化合物的形式存在于矿物内(例如独居石和钍石),通常与稀土金属连系在一起,主要作为质量数为232的同位素,半衰期为1.39×1010 年,放射出α粒子而形成新钍1 [thorium]——元素符号Th,钍外围电子排布是6d2 7s2,核外电子排布为2,8,18,32,18,10,2。同位素及放射线有Th-226[30.6m]、 Th-227[18.72d]、 Th-228[1.91y] 、Th-229[7340y]、 Th-230[75400y] 、Th-231[1.06d]、 Th-232(放 α[14000000000y])、 Th-233[22.3m]、 Th-234[24.1d]。 | 元素名称 | 钍 | 元素符号 | Th | 原子序数 | 90 | 相对原子质量
(12C=12.0000) | 232.0381 | | 英文名称 | Thorium | | 原子结构 | 原子半径(Å) | | 原子体积(cm3/mol) | 19.9 | 电子模型 | 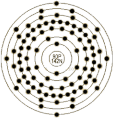 | | 电子构型 | 1s2 2s2p6 3s2p6d10 4s2p6d10f14 5s2p6d10 6s2p6d2 7s2 | 离子半径(Å) | 0.972 | | 共价半径(Å) | 1.65 | 氧化态 | 4 | | 发现 | 1829年由 J.J. Berzelius(瑞典,斯德哥尔摩)发现。 | | 命名起源 | after 'Thor', god of war (Scandinavian) | | 来源 | 存在于独居石,硅酸钍矿中。 | | 用途 | 用于高强度合金,紫外线光电池,用中子轰击可得到铀-233, 也用作核燃料。 | | 物理性质 | 状态 | 软的,银色放射性金属。 | 熔 点(℃) | 1755 | 沸 点(℃) | 4788 | | 密度(g/cc,300K) | 11.724 | 比 热(J/gK) | 0.12 | 蒸发热(KJ/mol) | 514.4 | | 熔化热(KJ/mol) | 16.1 | 导电率(106/cm) | 0.0653 | 导热系数(W/cmK) | 0.54 | | 自燃点(℃) | - | 闪 点(℃) | - | | | | 化学性质 | | | 地质数据 | 丰 度 | | 滞留时间(年) | 50 | 太阳
(相对于 H=1×1012) | c.2 | | 海水中(ppm) | 9.2×10-6 | 地壳(ppm) | 12 | 大西洋表面 | - | | 太平洋表面 | - | 大气(ppm(体积)) | - | 大西洋深处 | - | | 太平洋深处 | - | | | | | | 生物数据 | 人体中含量 | | 肝(ppm) | - | | 器官中 | | 肌肉(ppm) | - | | 血(mg dm-3) | 0.00016 | 日摄入量(mg) | 0.00005-0.003 | | 骨(ppm) | 0.002-0.012 | 人(70Kg)均体内总量(mg) | c.0.1 |
钍的同位素信息 | 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 | | [227] | - | 227.027699 | | | | | | | | [228] | - | 228.028731 | | | | | | | | [229] | - | 229.031754 | | | | | | | | [230] | - | 230.033126 | | | | | | | | [231] | - | 231.036296 | | | | | | | | [232] | - | 232.03805 | | | | | | | | [234] | - | 234.043595 | | | | | | |
| |
您可能感兴趣的产品:
|