氙(Xe)
氙,原子序数54,原子量131.29,为稀有气体。1898年由英国化学家拉姆赛和特拉弗斯在分馏液态空气时发现。氙在地壳中的含量极少,主要来源于空气。有9种稳定同位素,分别是氙124、126、128、129、130、131、132、134、136,都没有放射性。
氙为无色、无味气体;熔点-111.9℃,沸点-107.1℃,气体密度5.887克/升;水中溶解度108.1厘米3/千克水。
氙是稀有气体中唯一能在室温下形成稳定化合物的元素。1962年首次合成氙的化合物,此后又合成许多氙的化合物,主要是氟化氙和氙的氧化物;氟化氙有三种,都是无色晶体,在室温干燥的条件下非常稳定;氙的氧化物有两种;还有一种氙的氟氧化物。
| 元素名称 | 氙 | 元素符号 | Xe | 原子序数 | 54 | 相对原子质量
(12C=12.0000) | 131.29 |
| 英文名称 | Xenon |
| 原子结构 | 原子半径(Å) | 1.24 | 原子体积(cm3/mol) | 37.3 | 电子模型 | 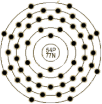
|
| 电子构型 | 1s2 2s2p6 3s2p6d10 4s2p6d10 5s2p6 | 离子半径(Å) | |
| 共价半径(Å) | 1.31 | 氧化态 | 0 |
| 发现 | 1898年由 William Ramsay 和 M.W. Travers (英国,伦敦)发现。 |
| 命名起源 | from 'xenos' (Greek) - stranger |
| 来源 | 从液化空气可获得极少量。 |
| 用途 | 用于闪光灯,发射灯,紫外灯,和其它电灯。 |
| 物理性质 | 状态 | 无色,无臭,无味的惰性气体。 | 熔 点(℃) | -111.7 | 沸 点(℃) | -107.97 |
| 密度(g/cc,300K) | 5.9 | 比 热(J/gK) | 0.158 | 蒸发热(KJ/mol) | 12.636 |
| 熔化热(KJ/mol) | 2.297 | 导电率(106/cm) | - | 导热系数(W/cmK) | 0.0000569 |
| 自燃点(℃) | - | 闪 点(℃) | - | | |
| 化学性质 | |
| 地质数据 | 丰 度 | | 滞留时间(年) | - | 太阳
(相对于 H=1×1012) | - |
| 海水中(ppm) | 1×10-4 | 地壳(ppm) | 2×10-6 | 大西洋表面 | - |
| 太平洋表面 | - | 大气(ppm(体积)) | 0.086 | 大西洋深处 | - |
| 太平洋深处 | - | | | | |
| 生物数据 | 人体中含量 | | 肝(ppm) | 零 |
| 器官中 | | 肌肉(ppm) | 零 |
| 血(mg dm-3) | 痕量 | 日摄入量(mg) | 未知,但非常低。 |
| 骨(ppm) | 零 | 人(70Kg)均体内总量(mg) | 未知,但很少。 |
氙的同位素信息
| 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 |
| 124 | 0.1 | 123.905895 | | | | | | |
| 126 | 0.09 | 125.904268 | | | | | | |
| [127] | 0 | 126.90518 | | | | | | |
| 128 | 1.91 | 127.903531 | | | | | | |
| 129 | 26.4 | 128.90478 | 1/2 | -1.347494 | -7.452103 | 0 | 27.810186 | 5.72×10-3 |
| 130 | 4.1 | 129.903509 | | | | | | |
| 131 | 21.2 | 130.905083 | 3/2 | 0.8931899 | 2.209076 | -11.4 | 8.243921 | 5.96×10-4 |
| 132 | 26.9 | 131.904155 | | | | | | |
| [133] | 0 | 132.905906 | | | | | | |
| 134 | 10.4 | 133.905395 | | | | | | |
| 136 | 8.9 | 135.90722 | | | | | | |